مقاله دنتول
اصطلاح بيوفيلم یا همان توده زیستي به سلول ها یا ميکروارگانيسم های متعاملي گفته مي شود که در اثر عوامل مختلف به دور یکدیگر جمع و بر روی یک سطح تثبيت شده اند. سطوحي که ميکروارگانيسم ها به آن متصل مي شوند ممکن است بافت های نرم زنده، یا سطوح غير زنده، مواد غوطه ور و یا ذرات خاک باشد. عموماً بيوفيلم به وسيله یک ماتریکس از مواد پليمری خارج سلولي(EPS) با منشاء ميکروبي احاطه شده اند. توانایي باکتری ها برای چسبيدن به سطوح، به ویژه در ارگانيسم های پاتوژن که از این خاصيت برای شروع بيماری استفاده مي کنند به عنوان یک پديده مهم شناخته شده است(1).
بيوفيلم عنوان رویکردی است که بعضي از ميکروارگانيسم ها از آن استفاده مي کنند تا بتوانند خود را از اثرات و نيروهای زیان بار محيط طبيعي و بدن ميزبان حفظ کرده و بدین گونه شانس بقای خود را افزایش دهند. زیرا وقتي باکتری ها تشکيل بیوفيلم مي دهند مقاومت آنها نسبت به شرایط نامساعد محيطي و بيوسایدها زیاد مي شوند، از این رو مسئله بيوفيلم ها در امر پزشکي و صنعت به یک معظل تبدیل شده است(2, 3). بیوفیلم ها سیستم های پیچیده ای هستند که تراکم سلولی خیلی بالایی ( حدود 108 تا 1011 عدد سلول باکتریایی در هر گرم) دارند و حاوی جمعیت میکروبی بسیار متنوعی می باشند(4). بیوفیلم ها می توانند تک لایه ای یا چندلایه ای باشند و نیز می توانند از جمعیت های باکتریایی همگون یا ناهمگون تشکیل شده باشند.
بيوفيلم ها منبع عفونت های سيستميک مقاوم به درمان مانند عفونت های مجرای ادراری، عفونت های کاتاتری، عفونت های مزمن در اندوکاردیت، عفونت های پوشش لنزهای تماسي، عفونت های گوش میانی، عفونت های دریچه قلبي و کاشت های جراحی می باشند(5).
عفونت های دهان و دندان از جمله شایع ترین عفونت های انسانی در سراسر جهان می باشند. شایع ترین این عفونت ها شامل پوسیدگی های دندانی، هالیتوزیس با منشاء دهانی، بیماری های لثه نظیر ژینژیوایتیس و بیماریهای پریودنتایتیس می باشند. باکتری ها اصلی ترین عامل بروز این عفونت های زیان آور می باشند. امروزه بیوفیلم های باکتریایی به عنوان مکانیسم اصلی بیماریزایی دخیل در بروز عفونت های دهان و دندان مطرح می باشند. باکتری های مختلف موجود در این بیوفیلم ها برهمکنش پیچیده و گسترده ای را با هدف ادامه بقای حیات خود برقرار می سازند(6). تجمع و متابولیسم باکتری ها بر روی سطوح سخت حفره دهانی و تشکیل بیوفیلم پلاکی، به عنوان اولین و اصلی ترین علت عفونت های دهان و دندان می باشند. حفره دهانی مسیر اصلی ورود به دستگاه گوارش می باشد و از منظر آناتومیکی، شرایط فیزیولوژیکی، میزان اکسیژن در دسترس و PH، نقاط مختلف حفره دهان تنوع بسیار بالایی دارد که خود این فاکتور، تنوع میکروبی موجود در اکوسیستم حفره دهانی را قویاً تحت تاثیر قرار می دهد. از سوی دیگر رژیم غذایی افراد، شرایط رعایت بهداشت حفره دهانی در افراد مختلف، سن، جنس، سطح هورمون های بدن، وضعیت سیستم ایمنی بدن و به ویژه ژنتیک از جمله مهمترین فاکتورهای تاثیر گذار بر روی این تنوع اکوسیستم میکروبی حاکم بر حفره دهانی می باشد. این تنوع مستقیماً و به شدت بر ساختار و جمعیت میکروبی بیوفیلم های که در حفره دهانی بر روی سطوح مختلف مخاطی و دندانی تشکیل می شود، اثر گذار می باشد و در واقع کنترل کننده نوع و تنوع جمعیت میکروبی بیوفیلم تشکیل شده در سطوح دهانی می باشد. اتصال میکروب ها به سطح حفره دهانی، پیش نیاز برای تشکیل بیوفیلم پلاک دندانی است(7).
بیماری های پریودنتال به وضعیتی گفته می شود که در آن لثه ها و سایر بافت های نگهدارنده دندانی، دچار بیماری گردند. این بیماری ها عمدتاً ناشی از عفونت های این بافت ها و التهاب ناشی از این عفونت ها ایجاد می گردند. باکتری های مسئول این عفونت ها، در داخل بیوفیلم ایجاد شده در این منطقه نظیر نواحی لثه ای و شکاف های بین لثه و دندان ها کلونیزه شده و رشد و تکثیر می یابند و تشکیل پلاک می دهند. باکتری ها می توانند تحت شرایط خاصی، با تکثیر بیش از حد منجر به ایجاد عفونت و التهاب شوند که التهاب ممکن است آسیب های جدی به لثه ها، لیگامان ها و استخوان های مجاور دندان ها وارد کند. ساده ترین نوع آن ژینژیوایتیس می باشد(8).
اجزای میکروبی سازنده بیوفیلم پلاک دندانی:
برخی از اجزای باکتریایی مانند گلیکوزیل ترانسفرازها و گلوکان در پلیکل اکتسابی مذکور یافت می شوند. استرپتوکوک های گرم مثبت نظیر استرپتوکوکوس سانگوئینیس، استرپتوکوکوس اورالیس، استرپتوکوکوس میتیس و گونه های نایسریا از اولین باکتری های کلونیزه شونده بر روی سطح دندانی هستند. که پلاک ابتدایی را تشکیل داده و با مصرف اکسیژن موجود شرایط را برای رشد باکتری های بی هوازی و بی هوازی اختیاری مثل گونه های اکتینومایسس، فوزوباکتریوم نوکلئاتوم، پریوتلا اینترمدیا و گونه های کاپنوسیتوفاگا فراهم می کنند. هم تجمعی بین گونه های گرم مثبتی نظیر استرپتوکوکوس سانگوئینیس و اکتینومایسس ها با گونه های گرم منفی مانند پریوتلا و فوزوباکتریوم نوکلئاتوم و نیز بین استرپتوکوکوس فوزوباکتریوم ها، به ترتیب صورت می گیرد(9). اگر طی 7 روز پلاک دهانی حذف نشود. شرایط به سرعت تغییر پیدا کرده و شرایط را برای رشد باکتری های بیهوازی بیماری زا نظیر استرپتوکوکوس موتانس، پورفیروموناس ژینژیوالیس، اگریگی باکتر اکتینومایستم کومیتانس، اکتینومایسز ویسکوزوس و اسپیروکت هایی مانند ترپونما را فراهم می کند ادامه این روند منجر به بروز پلاک دندانی و پوسیدگی دندان و ایجاد عفونت های دهانی می شود.
جنس مرزه از تیره نعناعیان، اغلب در مناطق مدیترانه ای پراکندگی دارد. بررســی ترکیبات ســازنده گیاه مــرزه در مطالعات مختلــف نشــان داده اســت کــه ایــن گیــاه خــواص آنتی بیوتیکــی دارد. گروه هــای عامــل و ســاختارهایی کــه باعــث ایــن خاصیــت گیــاه مــرزه شــده اند، در مطالعــات مختلــف بررســی شــده اســت. بیــن تمامــی ســاختارهای گیــاه مــرزه مشــخص شــده اســت که کارواکــرول بــه عنــوان جزء اصلــی ســازنده اســانس مهمتریــن نقــش را در خاصیــت ضدباکتریایــی ایــن گیــاه دارد(10, 11). در برخــی از مطالعــات اثــر اســانس گیــاه مــرزه بــر برخی از باکتری هــای دهانــی بررســی شــده اســت. و نتایج نشان داده است که کارواکرول بر اکثر جمعیت غالب باکتریایی ایجاد کننده ی عفونت های دهانی موثر است. از جمله ی این باکتری ها می توان به Streptococcus mutans, S. sanguis, S. mitis , S. milleri, Peptostreptococcus anaerobius, Prevotella buccae, P. oris , P. intermedia , . fluconazole resistance candida albicans، Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, Fusobacterium nucleatum, Campylobacter rectus،
اشاره کرد. همچنین کارواکرول می تواند بر دیگر باکتری ها از جمله باکتری های آلوده کننده مواد غذایی تاثیر گذاشته و مانع رشد آنها شود. از جمله ی این باکتری ها می توان به باکتری های Pseudomonas aeruginosa، Staphylococcus aureus، E. faecalis، Salmonell Spp.، Shigella sonnei، S. flexneri و S. dysenteriae اشاره کرد(6, 12).
تیم تحقیقاتی شرکت داروسازی خرمان خاصیت آنتی باکتریال داروی دنتول را بر پاتوژن های دهانی و همچنین پاتوژن های رودهای بررسی کرده اند که نتایج آن نشان دهنده تاثیر داروی دنتول بر مهار رشد باکتریهای Streptococcus pyogenes PTCC1447، Staphylococcus aureus PTCC1113، Escherichia coli PTCC1330، Salmonella typhi PTCC 1639، Enterococcus faeclis PTCC1237، Listeria monocytogenes PTCC1298 و Bacillus cereus PTCC1015 شود.
همچنین در مطالعه بالینی انجام شده روی 40 نفر فرد شرکت کننده در آزمایش نتایج نشان دادند که داروی دنتول باعث کاهش چشمگیر بار میکروبی و همچنین پاتوژن های مهم بیماریزای دهانی در افراد دریافت کننده دارو شود. این تفاوت ها از نظر آماری معنی دار بودند.
دنتول محصول نام آشنای شرکت داروسازی خُرّمان سال هاست که به عنوان ضدعفونی کننده، ازبین برنده ی عفونت های دندانی و همچنین کاهنده درد در پوسیدگی های دندانی استفاده می شود. در طی سالیان گذشته مطالعات متعددی بر روی این دارو انجام شده است که در ادامه به آنها اشاره می شود.
مطالعات بالینی
مقایسه کلینیکال، میکروبیولوژیکال و ایمنولوژیکال بین دنتول و کلرهگزیدین در پاکسازی لثه با پریودندیت پیشرفته.
هدف این مطالعه مقایسه کلینیکال، میکروبیولوژیکال و ایمنولوژیکال بین دنتول و کلرهگزیدین 2/0 درصد در پاکسازی لثه با پریودندیت پیشرفته انسان بود. به این منظور 20 بیمار با پریودندیت پیشرفته بطور تصادفی انتخاب شده و یک روز در میان به مدت 29 روز پس از بررسی های اولیه، ترمیم ریشه و آموزش بهداشت دهان با دنتول (بعنوان تست) و کلرهگزیدین 2/0 درصد (بعنوان کنترل) مورد درمان قرار گرفتند. عمق شیار (PD)، خونریزی حاصل از کاوش (BOP) و شاخص پلاک (PI) بعنوان معیارهای کلینیکالی در نظر گرفته شدند. تعداد کل باکتری های هوازی و بی هوازی در پلاک های لثه اندازه گیری شدند. در نهایت، غلظت TNF-α و IL-1β در مایع شیار لثه بعنوان نشانگر تورم مورد محاسبه قرار گرفتند. نتایج: PD و BOP در هر دو گروه در روز 29 ام و دو هفته بعد کاهش یافتند. PI هیچگونه تغییرات معناداری میان گروه ها نشان نداد (05/0 p >). نتایج نشان دادند که هر دو داروی دنتول و کلرهگزیدین قدرت نابود سازی قابل توجهی بر روی باکتری های غیر هوازی لثه داشتند (05/0 p <). در هر دو گروه تعداد کلی باکتری های هوازی لثه افزایش یافت، اما اختلافات در بین دو گروه بطور آماری به نفع دنتول بالا بود (05/0 p<). سطح IL-1β در مایع شیار لثه در هر دو گروه کاهش یافت، اما این کاهش در گروه تست مشهودتر بود. سطح TNF-α نیز در هر دو گروه کاهش یافت، اما تفاوت آماری در بین دو گروه قابل چشم پوشی بود (05/0 p >). با توجه به نتایج به دست آمده می توان عنوان نمود که استفاده دنتول حاوی 02/0 درصد کارواکرول در کاهش علایم متورم کلینیکال و ایمنولوژیکال و پاکسازی لثه، به صورت یک روز در میان به مدت 29 روز با مصرف کلرهگزیدین 2/0 درصد برابری کرده و حتی موثرتر است(11) .
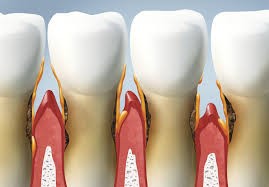

هر چه مدت زمان ماندگاری پلاک و رسوب روی دندان ها طولانی تر شود، دندان ها صدمات بیشتری می بینند. باکتری ها باعث صدمه و التهاب بافت لثه می شوند که آنرا "التهاب لثه" گویند. در التهاب لثه، لثه ها قرمز و متورم شده و به سادگی دچار خونریزی می شوند. التهاب لثه حالت معتدلی از بیماری های لثه می باشد که معمولاً می توان با مسواک زدن و استعمال روزانه نخ دندان و همچنین مراجعه مرتب به دندان پزشک و رعایت اصول بهداشتی دهان آنرا از بین برد.
پیوره (پریودنتیت):
پیوره مجموعه ای از بیماری های التهابی می باشد که لثه را تحت تاثیر قرار می دهد؛ مانند، بافت نگهدارنده و حفاظت کننده دندان. اگر التهاب لثه درمان نشود می تواند باعث ایجاد پیوره شود که به معنی التهاب اطراف دندان می باشد. در پیوره لثه از دندان دور شده و ایجاد فضاهایی بنام شیار می کند که عفونی می شوند. همچنین سیستم ایمنی بدن با انتشار پلاک ها با باکتری ها مقابله کرده و در لایه زیرین لثه تجمع می یابد. مجموع سموم باکتری ها و پاسخ طبیعی بدن به عفونت باعث شروع تجزیه استخوان و بافت پیوندی نگهدارنده دندان می شود. اگر پیوره درمان نشود لثه و بافت محافظت کننده دندان تخریب شده و دندان از بین رفته و نهایتاً نیاز به برداشت و کشیدن دندان می شود.
مطالعه بالینی
فعالیت ضد باکتریایی اسانس مرزه خوزستانی بر علیه پاتوژن های دهان.
در یک پژوهش، اثر باکتری کشی اسانس مرزه خوزستانی از گیاهان بومی ایران، بعنوان یک ضدعفونی کننده درون کانال و داروی موضعی بررسی شد. برای این منظور، فعالیت ضد میکروبی و حداقل غلظت بازدارنده (MIC) اسانس مرزه همراه و بدون هیدروکسید کلسیم علیه یازده باکتری هوازی، میکروائروفیل و بی هوازی مورد آزمایش قرار گرفت. ارزیابی بوسیله رقت سازی آگار و انتشار در چاهک انجام شد. مناطق بازدارندگی و تغییرات رنگ بوسیله یک ناظر مستقل اندازه گیری و ثبت گردید. آنالیز آماری داده ها نیز بوسیله تست Student t-testانجام شد. نتایج این مطالعه به شرح زیر بود.
MIC برای هشت گونه باکتری در غلظت 31/0 میلی گرم/میلی لیتر اسانس ثبت شد. باکتری Pseudomonas aeruginosa با MIC 25/1 میلی گرم/میلی لیتر مقاوم ترین باکتری به اسانس بود، درحالیکه تنها 16/0 میلیگرم/میلی لیتر از اسانس مرزه برای جلوگیری از رشد Bacillus subtilis و Staphylococcus aureus کافی بود. منطقه بازدارندگی برای فعالیت ضدعفونی کنندگی اسانس برای E. faecalis در روش انتشار در چاهک 13 میلیمتر بود، که این نتیجه قابل مقایسه بود با قطر بازدارندگی 5/12 میلیمتر در دیسک تتراسایکلین (30 میکروگرم). همچنین اثر سینرژیکی در حالت ترکیبی اسانس و هیدروکسید کلسیم مشاهده نشد. با توجه به نتایج به دست آمده به نظر می رسد اسانس مرزه خوزستانی در غلظت 31/0 میلی گرم/میلی لیتر بر روی اکثر پاتوژن های دهانی از جمله E. faecalis موثر می باشد(13) .

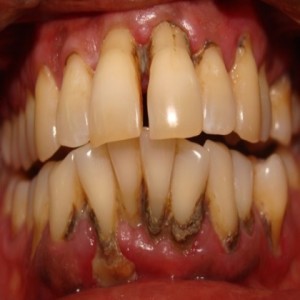
آفت دهان یک اتفاق متداول حتی در افراد سالم بوده که از خصوصیات آن زخم های دهانی خوش خیم و غیر مسری (آفت) می باشد. این زخم ها در فواصل زمانی معینی رخ داده و بطور کامل در بین حملات التیام می یابند. در اکثر موارد زخم ها به مدت 7 الی 10 روز ماندگار بوده و زخم ها هر ساله 3 الی 6 بار رخ می دهند.
مطالعه بالینی
تاثیر عصاره و اسانس مرزه خوزستانی بر روی آفت عود کننده دهان.
هدف این مطالعه ارزیابی اثر عصاره مرزه خوزستانی جمزاد و اسانس آن در درمان آفت عود کننده دهان (RAS) برای توضیح استفاده رایج آن بعنوان داروی ضد درد و التیام دهنده زخم بود. برای این منظور، ابتدا60 بیمار با آفت خفیف انتخاب شده و بطور تصادفی در سه گروه تقسیم شدند. گروه A و B به ترتیب عصاره و اسانس مرزه خوزستانی را بطور موضعی مصرف نمودند. گروه C (گروه کنترل) محلول آبی – الکلی را بعنوان دارونما دریافت نمودند. تاریخ از بین رفتن درد و همچنین مدت زمان مورد نیاز برای التیام زخم ثبت شدند. نتایج: میانگین زمان از بین رفتن درد تفاوت معنی داری بین گروه A و B با گروه C نشان داد. میانگین زمان مورد نیاز برای التیام کامل زخم نیز تفاوت معنی داری بین گروه A و B در مقایسه با گروه C نشان داد. اختلاف معنی داری بین گروه A با B در رابطه با هر دو متغیر مدت زمان تسکین درد و مدت زمان التیام زخم مشاهده نشد. با توجه به این نکته که نتایج بدست آمده از بررسی عصاره مرزه خوزستانی (گروه A) مشابه با نتایج حاصل از اسانس این گیاه (گروه B) بود. همچنین تاثیر بهتر عصاره و اسانس مرزه خوزستانی بر روی RAS در مقایسه با گروه کنترل (دارونما) نتیجه گرفته می شود که مرزه خوزستانی داروی گیاهی موثری جهت درمان و مدیریت آفت خفیف می باشد. نتایج این مطالعه می تواند دلایل استفاده رایج از این گیاه را تائید نماید(14) .


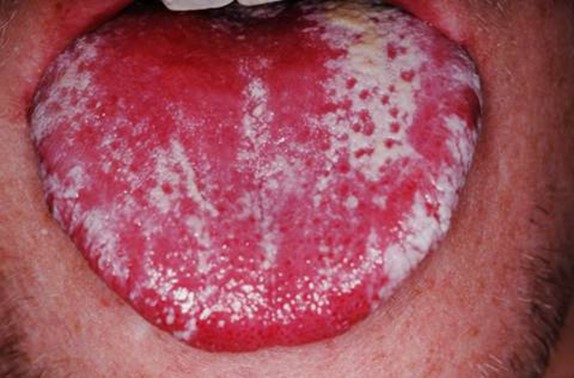
برفک دهانی یا کاندیدیازیس دهانی یک بیماری قارچی (عفونت مخمر/قارچی) بوده که در لایه موکوسی دهان بوسیله گونه های مختلف قارچ کاندیدا رخ می دهد. گونه کاندیدا آلبیکانس متداول ترین عامل این بیماری می باشد. کاندیدا آلبیکانس در دهان حدود 50 درصد جمعیت جهان بعنوان فلور طبیعی وجود دارد. این میزان کاندیدا نشان دهنده بیماری نمی باشد، اما زمانیکه گونه های کاندیدا بیماری زا شده و به بافت های میزبان حمله می کنند برفک دهانی رخ می دهد. این تغییر که باعث یک عفونت فرصت طلب توسط میکروارگانیسم هایی که بطور معمول بی خطر هستند، بعلت عوامل موضعی (برای مثال موکوس) یا سیستماتیک تغییر دهنده سیستم ایمنی میزبان بوجود می آید.
مطالعه بالینی
درمان ضد قارچی کاندیدیازیس دهانی با کارواکرول و اوژنول در موش های دارای نقص سیستم ایمنی.
در این مطالعه اثرات درمانی کارواکرول و اوژنول، ترکیبات فنولی اصلی اسانس برخی گیاهان معطر در درمان کاندیدیازیس دهانی القا شده توسط کاندیدا آلبیکانس در موش های دارای نقص سیستم ایمنی مورد مطالعه قرار گرفت. فعالیت ضد کاندیدیایی بوسیله تکنیک های میکروبیولوژیکی و آسیب شناسی بررسی شده و نتالیج آن با نیستاتین بعنوان کنترل مثبت، مورد مقایسه قرار گرفت. از نظر میکروبیولوژی، کارواکرول و اوژنول بطور قابل توجهی تعداد واحدهای تشکیل شده کولونی (CFU) بدست آمده از حفره دهانی موش های درمان شده به مدت هشت روز متوالی در مقایسه با موش های درمان نشده گروه کنترل را کاهش دادند. درمان با نیستاتین نتایج مشابهی بدست آورد. از نظر آسیبشناسی، حیوانات درمان نشده گروه کنترل تعداد زیادی هیف قارچی بر روی اپیتلیوم ناحیه پشتی زبان نشان دادند. در مقابل، رشد هیف در اپیتلیوم حیوانات درمان شده با کارواکرول مشاهده نشد، در حالیکه در موش های درمان شده با اوژنول تعداد کمی کولونی هیف در ناحیه پشتی زبان مشاهده شد. در گروه درمان شده با نیستاتین نیز هیف در چین های موکوسی زبان مشاهده شد. بدین ترتیب، داده های آسیب شناسی بوسیله آزمایشات میکروبیولوژیکی برای کارواکرول و اوژنول مورد تائید قرار گرفتند، اما نه برای گروه درمان شده با نیستاتین. بنابراین کارواکرول و اوژنول می توانند گزینه های مناسبی برای درمان برفک دهانی باشند(15) .

مطالعه بالینی
ارزیابی اثرات ضد قارچی اسانس های گیاهی مرزه خوزستانی بر روی کاندیدیازیس دهانی در رت های ایمونوساپرس
در این پژوهش اثرات ضدکاندیدایی اسانس مرزه خوزستانی در رت ایمونوساپرس مبتلا به کاندیدیازیس دهانی در شرایط درون تنی مورد بررسی قرار گرفت و از نیستاتین به عنوان شاهد دارویی استفاده شد. در این مطالعه 42 رت در 6 گروه 7 تایی: گروه درمان شده با اسانس مرزه خوزستانی، گروه درمان شده با نیستاتین، گروه دارونما، گروه غیر ایمنوساپرس ولی آلوده، گروه ایمنوساپرس اما غیر آلوده مورد بررسی قرار گرفت. ارزیابی سطح عفونت وتعیین اثرات درمانی به وسیله روش های میکروبیولوژیکی و هیستو پاتولوژیکی و معاینات بالینی صورت گرفت. برای ارزیابی میکروبیولوژیکی در مراحل مختلف تحقیق طی 5 نوبت شامل قبل از ایمنوساپرس، بعد از ایمنوساپرس و قبل از تلقیح و در روزهای صفر، چهار و هشت درمان از دهان حیوانات به وسیله سواپ استریل نمونه گیری به عمل آمد. سپس سوآپ ها در یک میلی لیتر سرم فیزیولوژیک استریل قرار گرفته و پس از هموژنیزه نمودن آنها ، برای تعیین میانگین کمیت CFU ، اقدام به کشت نمونه ها نمودیم. تعیین CUF بصورت دوبلیکیت صورت گرفت. ارزیابی سطح عفونت و تعیین میزان اثرات داروها توسط تعیین CFU در گروه های درمان شده و مقایسه آنها با گروه دارونما ارزیابی شد و برای مقایسه سطح معنی دار بودن تفاوت های گروه دارونما با سایر گروه ها از آزمون Independent Sample T-Test و برای بررسی سطح معنی داری تفات های گروه ها در طی روند درمان از آزمون تجزیه واریانس یک طرفه استفاده گردید. برای ارزیابی هیستوپاتولوژیک، در پایان دوره درمان ( روز هشتم ) زبان همه رت های موجود در گروه های مختلف درمانی از دهان خارج و پس از مرحله ثبوت و طی مراحل پاساژ بافتی با دو متد رنگ آمیزی H&E و PAS رنگ آمیزی شدند و با مشاهده یا عدم مشاهده عناصر مخمری و هایفی و نفوذ آنها به داخل اپیتلیوم سطح پشتی زبان مورد ازیابی قرار گرفتند . از مجموع ارزیابی های میکروبیولوژیکی و هیستوپاتولوژیکی و معاینات بالینی دهان رت ها چنین نتیجه گیری شد که درمان کاندیدیازیس دهانی توسط اسانس مرزه خوزستانی با غلظت دارویی معادل 2 برابر MIC در رت های ایمنوساپرس به مدت یک هفته کاملاً موفقیت آمیز بوده و معادل یک هفته درمان توسط نیستاتین با غلظت دارویی معادل 10 برابرMIC بوده است(16).
1. Kassen R, Rainey PB. The ecology and genetics of microbial diversity. Annu Rev Microbiol. 2004;58:207-31.
2. Allison DG, Ruiz B, SanJose C, Jaspe A, Gilbert P. Extracellular products as mediators of the formation and detachment of Pseudomonas fluorescens biofilms. FEMS microbiology letters. 1998;167(2):179-84.
3. Climent J. The impacts of nanoparticles on planktonic and biofilm bacteria a thesis of doctor of philosophy school of geography. Earth Environ Sci2009.2:1-241.
4. Balzer M, Witt N, Flemming H-C, Wingender J. Faecal indicator bacteria in river biofilms. Water Science and Technology. 2010;61(5):1105-11.
5. Cortés ME, Bonilla JC, Sinisterra RD. Biofilm formation, control and novel strategies for eradication. Sci Against Microbial Pathog Commun Curr Res Technol Adv. 2011;2:896-905.
6. Forssten SD, Björklund M, Ouwehand AC. Streptococcus mutans, caries and simulation models. Nutrients. 2010;2(3):290-8.
7. Singer SW, Erickson BK, VerBerkmoes NC, Hwang M, Shah MB, Hettich RL, et al. Posttranslational modification and sequence variation of redox-active proteins correlate with biofilm life cycle in natural microbial communities. The ISME journal. 2010;4(11):1398-409.
8. Selwitz RH, Ismail AI, Pitts NB. Dental caries. The Lancet. 2007;369(9555):51-9.
9. Zijnge V, van Leeuwen MBM, Degener JE, Abbas F, Thurnheer T, Gmür R, et al. Oral biofilm architecture on natural teeth. PloS one. 2010;5(2):e9321.
10. HOSSEIN ZH, Delfan B. Evaluation of antibiofilm activity of dentol. 2009.
11. Shahab A, Haghighati F, Baeeri M, Jamalifar H, Abdollahi M. A clinical, microbiological and immunological comparison between subgingival irrigation with Dentol™ and chlorhexidine in advanced periodontitis. Archives of medical science: AMS. 2011;7(1):154.
12. Burt SA, Fledderman MJ, Haagsman HP, van Knapen F, Veldhuizen EJ. Inhibition of Salmonella enterica serotype Enteritidis on agar and raw chicken by carvacrol vapour. International Journal of Food Microbiology. 2007;119(3):346-50.
13. Seghatoleslami S, Samadi N, Salehnia A, Azimi S. Antibacterial activity of endemic Satureja Khuzistanica Jamzad essential oil against oral pathogens. Iranian endodontic journal. 2009;4(1):5.
14. Amanlou M, Farsam H, Babaei N, SAHEB JM, TOHI DAZ, Salehnia A. Efficacy of Satureja khuzistanica extract and its essential oil preparations in the management of recurrent aphthous stomatitis. 2007.
15. Chami N, Chami F, Bennis S, Trouillas J, Remmal A. Antifungal treatment with carvacrol and eugenol of oral candidiasis in immunosuppressed rats. Brazilian Journal of Infectious Diseases. 2004;8(3):217-26.
16. Raut JS, Karuppayil SM. A status review on the medicinal properties of essential oils. Industrial crops and products. 2014;62:250-64.


